バリデーションサポート
医薬品製造プラントのバリデーション
当社は、長年にわたる培養装置の製作を通して、サニタリー配管、制御システムのノウハウを蓄積し、現在、培養装置を中心とした培地調製システム~培養システム~細胞(微生物)分離システム~精製システムまで、一連のシステムを構築しています。平成13年に発令された原薬GMPのガイドライン以前から、バリデーションドキュメントを欧米メーカにならい、作成してきました。現在、装置に関わるICH、PIC/S等のレギュレーションに準拠する体制を整えています。
サポート内容
ドキュメントのサポート
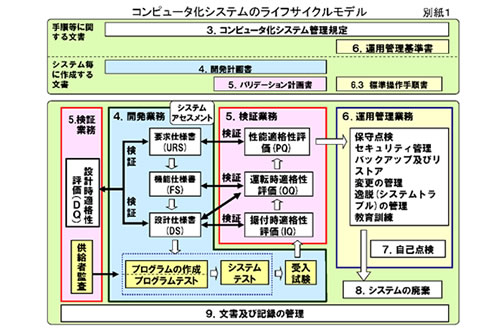
・設計時適格性確認 (Design Qualification, DQ)
・据付時適格性確認 (Installation Qualification, IQ)
・運転時適格性確認 (Operation Qualification, OQ)
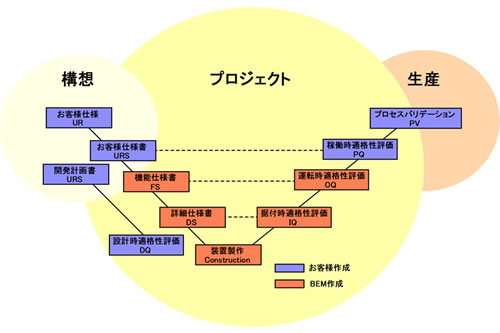
すべてのステージにおけるドキュメントをサポートしています。更に、構想段階の顧客要求書(UR)からはじまり、その仕様を確定する段階の顧客要求仕様書(URS)、機能仕様書(FS)及び詳細仕様書(DS)など、設計時適格性確認(DQ)に必要な書類の作成及びサポートを行います。
顧客要求仕様書(URS)作成のサポート
培養装置など扱ったことが無いお客様にとって、この顧客要求仕様書(URS)を作成するのは、非常に大きな負担であると考えられます。当社は、お客様の構想段階(それこそ、A4一枚の構想)からご相談を受けたものに関しては、ドラフトの機能仕様書の作成を通じて、顧客要求仕様書(URS)へ展開するサポートを行っています。顧客要求仕様書(URS)と機能仕様書(FS)の項目を同じフォームにすることで、トレーサビリティマトリックスの作成など、次の展開が容易になります。

CSV(コンピュータシステムバリデーション)実施のサポート
コンピュータ使用医薬品等製造所適正管理ガイドライン(平成4年2月21日薬監第11号)から、はじまり、日本には、CSVに関するレギュレーションがないと叫ばれた時代、当社は、GAMP3、Part11、GAMP4と世界のガイドライン及びレギュレーションを参考に、CSV実施の技術レベルを向上させてきました。GAMP5の発刊、 医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドラインの発令と、日本を取り巻く、CSV環境は目まぐるしく変わっています。当社は、日々、新たなレギュレーションやガイドラインを熟読し、CSV実施レベルを向上させています。
製品に関するご相談、ご依頼はお気軽にお問い合わせください。